(Pungitius Coste, 1848) Род Пунгитиусы, Девятииглые колюшки, Многоиглые колюшки, Малые колюшки, Genus Pungitius Coste, 1848 (Ninespined sticklebacks) 7 видов
Фауна СССР. Рыбы. Том V, вып. 1. Семейство Колюшковых (Gasterosteidae) мировой фауны. В.В.Зюганов 1991 г.
3. Род PUNGITIUS Coste, 1848
— Pungitius Coste, 1848 : 588 (типовой вид Gasterosteus pungitius Linne, 1758, по последующему обозначению).
— Pygosteus Вrevооrt in Gill, 1861 : 39 (типовой вид Pygosteus occidentalis, Cuvier et Valenciennes, 1829 = Gasterosteus pungitius Linne, 1758, по последующему обозначению).
— Gasterostea Sauvage, 1874 : 29 (типовой вид Gasterosteus pungitius Linne, 1758, по последующему обозначению).
— Pungitius Fatiо, 1882 : 97 (типовой вид Gasterosteus pungitius Linne, 1758, по последующему обозначению).
— Gasterosteops Stilkо, 1934 : 59 (типовой вид Gasterosteus hexacanthus по первоначальному обозначению).
— Pygosteus : Bertin, 1925 : 161.
— Pungitius : Берг, 1949 : 965; Münzing, 1969 : 206; Wootton, 1976 : 266.
Супраклейтрум присутствует; эктокоракоид простирается вперед дальше клейтрума и соединяется с ним, образуя V-образную структуру с острым углом. Задние отростки тазового пояса примыкают друг к другу, образуя брюшной щит, восходящая дуга есть: с округлым или прямым дорсальным краем. Брюшная колючка зазубренная или гладкая, с 1 или 2 мягкими лучами или без мягких лучей и расположена на уровне 6—7-го позвонков под серединой грудного плавника. (В ряде популяций видов Pungitius pungitius, Pungitius platygaster, Pungitius tymensis брюшные колючки отсутствуют.) Гипуральная пластина слитная. Перед спинным плавником (6) 7—12 (13) колючек, направленных в разные стороны (зигзагообразно). (В Ирландии и Греции у Pungitius pungitius бывает 1—6 спинных колючек.) Соотношение числа спинных колючек и птеригиофоров 1:1, птеригиофоров меньше, чем позвонков. Позвонков 29—35. Жаберные перепонки сращены между собой и образуют свободную складку поперек межжаберного промежутка. Тело голое или покрыто костными пластинами. Хвостовой стебель с килем или голый. Форма хвостового стебля (вид в разрезе) изменчива (более сжата латерально, чем дорсовентрально, но у Pungitius platygaster, наоборот, хвостовой стебель шире, чем выше). Рыло умеренно удлиненное, не трубковидное. Длина до 9 см. 4 вида в Евразии и Сев. Америке.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ВИДОВ И ПОДВИДОВ
1 (8). Хвостовой стебель с боковыми хорошо развитыми килями или без киля.
2 (7). Тело голое или покрыто в передней части мелкими костными пластин
ками, без крупных костных пластинок.
3 (6). Восходящая дуга тазового пояса (боковые отростки тазовой кости) хорошо развита, брюшные колючки длинные, в 1.7—3 раза меньше длины головы. Спинные колючки высокие. 1. Pungitius pungitius (L.)
4 (5). Тело покрыто в передней части мелкими костными пластинками. Хвостовой стебель с хорошо развитым килем. Циркумполярный ареал. 1а. Pungitius pungitius pungitius (Linne)
5 (4). Тело голое, хвостовой стебель гладкий, без киля. Западная Европа. 1б. Pungitius pungitius laevis (Cuvier)
6 (3). Боковые отростки тазовых костей почти отсутствуют, брюшные колючки короткие, в 5—7.5 раза короче длины головы. Спинные колючки очень короткие. 2. Pungitius tymensis (Nikolsky)
7 (2). Тело полностью покрыто костными боковыми пластинками. 3. Pungitius sinensis (Guichenot)
8 (1). Хвостовой стебель гладкий с боков, без киля. Тело полностью или передняя часть тела покрыты вертикальными костными пластинками. 4. Pungitius platygaster (Kessler)
9 (10). Брюшная колючка ясно зазубрена. Бассейны Черного и Каспийского морей. 4а. Pungitius platygaster platygaster (Kessler)
10 (9). Брюшная колючка слабо зазубрена или не зазубрена. Бассейн Аральского моря. Pungitius platygaster aralensis (Kessler) 4б.
Изменчивость окраски девятииглых колюшек рода Pungitius также значительна. Зимой верх головы и спина Pungitius pungitius темно-голубого цвета, бока серебристо-белые с очень мелкими черными пятнышками, сходную окраску имеет и амурская колюшка, Pungitius sinensis, обитающая, как и Pungitius pungitius, вне сезона размножения в открытых частях водоемов. А два других вида — Pungitius platygaster и Pungitius tymensis (малая южная и сахалинская колюшки), предпочитающие держаться в литоральной зоне с густой растительностью, имеют камуфлирующую окраску — ряд зеленовато-бурых полос и пятен на оливковом фоне. У всех видов и форм девятииглых колюшек рода Pungitius самцы в нерестовый сезон претерпевают одинаковые изменения — тело их становится черным (спина, бока тела и брюхо), а брюшные колючки белыми (они являются ориентиром для самки при ведении ее к гнезду). Тем не менее различия между видами наблюдаются и по брачной окраске самцов. Так, брюшные колючки Pungitius pungitius приобретают интенсивную голубовато-белую окраску и хорошо различимы в воде, у самцов же Pungitius platygaster вся передняя часть брюшных колючек темного цвета, светлеет лишь задняя, обращенная к самке во время ведения ее к гнезду. Самки Pungitius platygaster и в брачный период сохраняют камуфлирующий наряд — пятна на оливковом фоне; у них полностью отсутствует «зеркальце» — блестящее пятно, не покрытое темным пигментом кожи на боках тела, характерное для самок Pungitius pungitius в нерестовый сезон (Гомелюк, 1978). Внутри вида Pungitius pungitius имеется межпопуляционная изменчивость по брачной окраске самцов: в отличие от самцов «типичных» популяций, самцы из озера Гурон (Великие озера), где отсутствует зона растительности, не становятся черными по всей поверхности тела; вместо этого на брюшной стороне тела развивается «серый лоскут», на фоне которого хорошо заметны голубовато-белые колючки. Этот «лоскут» становится блестяще-черным во время фазы ухаживания и охраны икры.
Все виды девятииглых колюшек рода Pungitius (Pungitius pungitius, Pungitius platygaster, Pungitius tymensis, Pungitius sinensis) в Евразии не обнаруживают заметной изменчивости по числу спинных колючек (пределы колебаний 7—11, модальное число колючек 8—10) и достоверно не отличаются по средним (Зюганов, 19846). Существуют две географические точки, где число спинных колючек у Pungitius pungitius меньше 8: Ирландия (Ure, 1962, — цит. по: Nelson, 1971а), где найдены рыбы даже с 1 спинной колючкой, и Греция (бассейн р. Сперхиос), где у рыб встречается от 1 до 6 спинных колючек (Stephanidis, 1971).
На Дальнем Востоке среди 3 видов девятииглых колюшек наблюдаются достоверные различия по длине спинных колючек: у солоноватой формы Pungitius pungitius они длиннее, чем у пресноводной пелагической Pungitius sinensis, а у последней в свою очередь длиннее, чем у придонной, обитающей в зоне густой вегетации, Pungitius tymensis, отличающейся очень короткими спинными и брюшными колючками. Pungitius tymensis также отличается меньшим числом спинных колючек от Pungitius sinensis и Pungitius pungitius. Различия по длине спинных колючек между Pungitius tymensis и двумя другими видами, очевидно, генетически закреплены, поскольку полученные в эксперименте гибриды tymensis х pungitius и tymensis х sinensis обнаруживают мозаичность по этому признаку: перед спинным плавником у них чередуются длинные и короткие колючки, т. е. гены взаимодействуют аддитивно (совместно, без доминирования) (Kobayashi, 1957).
В Европе спинные колючки Pungitius platygaster по длине меньше, чем у Pungitius pungitius (Зюганов, 19846), но различия эти недостоверны. Принимая во внимание более «зарослевый» образ жизни Pungitius platygaster, можно также было ожидать существенного уменьшения длины колючек, по аналогии с Pungitius tymensis, но, видимо, в лиманах Черного моря пресс хищников выше, чем в водоемах Сахалина (Гомелюк, 1978).
В Сев. Америке прибрежные популяции Pungitius pungitius (принадлежащей к так называемой берингийской форме) имеют достоверно большее число спинных колючек, чем колюшки из внутренних материковых популяций (миссисипская форма) (McPhail, 1963). Мак-Фейл полагает, что две формы переживали Висконсинское оледенение в разных рефугиумах (Берингийском и Миссисипском) и что различия по числу колючек означают различия в фенотипическом ответе организмов на условия среды во время развития.
Берингийская форма также имеет более длинные колючки, чем миссисипская, у первой наблюдается клина уменьшения длины колючек к северу, а у второй формы никаких пространственных клин не обнаружено (McPhail, 1963). Автор предполагает, что при высокой солености воды понижение температуры вызывает уменьшение длины колючек к северу.
Мне кажется, что и для родов Culaea и Gasterosteus хищники не являются общей причиной редукции таза. Вследствие того что роды занимают в водоеме разные ниши (более пелагическая и привязанная к открытым пространствам Gasterosteus aculeatus и придонная зарослевая Culaea inconstans), они несомненно имеют и разный набор хищников. Хищники эти применяют разную тактику охоты за жертвами, а жертвы разную тактику защиты. В частности, Gasterosteus aculeatus использует свои морфологические адаптации (крепкие и длинные спинные и брюшные колючки, скрепленные боковыми пластинками и восходящим отростком тазового пояса) и подпускает хищника на близкое расстояние (Hoogland et al., 1958), а Culaea inconstans, лишенная связи спинных и брюшных колючек посредством боковых пластин, должна использовать поведенческие адаптации, подобно такой же зарослевой форме, как Pungitius pungitius, которая, как известно, демонстрирует скрытное и осторожное поведение и реагирует на хищника с дальней дистанции (Wootton, 1976).
Нашу точку зрения подтверждает тот факт, что у Gasterosteus наблюдается четкая корреляция между редукцией таза и редукцией других защитных структур (спинными колючками, боковыми пластинами) (Campbell, 1979; Reimchen, 1980; Giles, 1983), а у Pungitius и Culaea такой корреляции нет, за исключением двух точек — в Ирландии (Nelson, 1971b) и Греции (Nelson, 1971b; Nelson, Atton, 1971; Stephanidis, 1971).
Обзор межродовой изменчивости колюшковых по числу боковых пластин выявляет 3 мономорфных рода, где нет заметной изменчивости по этому признаку (Spinachia, Culaea, Apeltes), и 2 чрезвычайно полиморфных рода Gasterosteus и Pungitius, включающих комплекс видов и форм, где в сумме реализованы 8 фенотипов, обнаруживающих удивительный межродовой параллелизм (Зюганов, 19836).
Все разнообразие морфологических вариантов по числу костных пластин в родах Gasterosteus и Pungitius по существу можно свести к 8 основным типам (рис. 4). Имеется всего 4 градации признака «пластины на теле»: 1) пластины полностью покрывают тело (20—30, чаще 25—27), 2) пластины частично покрывают тело (10—20, чаще 12—15), 3) пластин на теле мало (2—10, чаще 5—7), 4) пластин на теле нет (0). Это не условно выделяемые градации с плавным непрерывным переходом друг в друга, а реально существующие дискретные варианты в природных популяциях; если строить кривую распределения этого признака, суммируя множество популяций, то мы получим 4-модальную кривую с 4 пиками и 3 провалами между ними.

Имеется также 2 градации признака «киль на хвостовом стебле»: а) киль есть, б) киля нет. Более дробное разделение — киль сильно выражен и киль слабо выражен — мы не учитываем (здесь, как и в любой другой классификации живых объектов, неизбежно некоторое огрубление, поскольку чрезмерное дробление еще более опасно, чем огрубление).
Таким образом, все возможные сочетания 4 градаций пластин на теле и 2 градаций киля дают нам 8 возможных фенотипов (= морф, = морфотипов) у Pungitius и Gasterosteus. На основании литературных данных и собственных эксперименов по скрещиванию разных морф я полагаю, что пластины на теле и киль — два разных признака, детерминируемые разными локусами, но в ряде популяций эти локусы сцеплены (Зюганов, 1983 г.).
Как и всякая попытка формализации, эта схема не лишена некоторых элементов условности. Например, в полиморфных природных популяциях Gasterosteus aculeatus иногда трудно отнести некоторые особи к варианту 1 (а) (trachurus) или к 2 (а) (semiarmatus) в том случае, когда у этих особей имеется разрыв шириной в одну пластину между пластинами на теле и килем. Однако Хаген и Гильбертсон (Hagen, Gilbertson, 1973) отмечали, что скрещивания между такими особями давали расщепления в F1, характерные для trachurus. Скрещивания между особями с аналогичными разрывами, но шириной в 2 пластины (или более) давали расщепления, характерные для semiarmatus. Бывают случаи, когда с одной стороны тела у рыбы полный ряд пластин, а с другой — разрыв между килем и пластинами на теле. В этом случае, вероятно, надо при отнесении рыбы к тому или иному морфотипу ориентироваться на ту сторону, где признак наиболее развит, а другую сторону считать недоразвитием признака. Я не исключаю также возможности существования в ряде случаев фенокопий (модификация фенотипа, вызванная особыми условиями среды, напоминающая изменение фенотипа, обусловленное мутацией) (Майр, 1974), хотя до сих пор у трехиглой колюшки они обнаружены не были (Hagen, Gilbertson, 1973).
Род Pungitius. В нем реализованы все 8 фенотипов, причем в отличие от Gasterosteus каждый фенотип имеет достаточно широкую распространенность. Тем не менее самое ограниченное распространение имеет фенотип 2(a) (semiarmatus), встречаясь лишь в гибридных зонах интрогрессии между Pungitius sinensis и Pungitius pungitius в Японии на островах Хонсю (Tanaka, 1982), Хоккайдо (S. Tanaka, личн. сообщ.) и в СССР на Сахалине (наши данные). Вид Pungitius sinensis имеет фенотип 1(а) (обширный ареал на Дальнем Востоке от Кореи до Камчатки). Форма Pungitius platygaster имеет фенотип 1(b) (бассейны Черного и Каспийского морей). Форма Pungitius platygaster aralensis имеет фенотип 2(b) (бассейн Аральского моря). Фенотип 3(a) представлен видами Pungitius pungitius (обширный циркумполярный ареал в Евразии и Сев. Америке) и Pungitius tymensis (Сахалин и Хоккайдо); фенотип 3(b) — многими популяциями Pungitius platygaster aralensis; фенотип 4 (а) — миссисипской формой Pungitius pungitius (Сев. Америка) и многими популяциями вида Pungitius tymensis, фенотип 4(b)— формой Pungitius pungitius laevis (Франция, Великобритания).
Как можно видеть из всего вышеизложенного, в изменчивости по боковым пластинам между родами Gasterosteus и Pungitius наблюдается поразительный параллелизм, и фенотипы по числу пластин в обоих родах образуют гомологические ряды.
Плечевой пояс колюшковых состоит из следующих костей: cleithrum, scapula, coracoid и ectocoracoid, а также костей posttemporale и supracleithrum, связывающих грудной скелет с черепом (рис. 9). Лучи грудного плавника, за исключением самого верхнего, сочленены с 4 actinost (radialii), которые расположены сразу же за scapula и coracoid. Наиболее дорсально расположенная posttemporale (на самом деле являющаяся костью головного отдела) примыкает к черепу. Связь posttemporale с черепом самая прочная у Gasterosteus aculeatus, а самая непрочная у Culaea; у других родов степень прочности сочленения промежуточна. У Gasterosteus wheatlandi posttemporale отсутствует, у Gasterosteus aculeatus она имеет ромбическую форму. Supracleithrum — маленькая узкая кость, которая связана с posttemporale и cleithrum. Cleithrum у всех колюшковых имеет вид длинной и прямой рукоятки с широкой треугольной головкой в верхней дорсальной части кости (Nelson, 1971а). Gasterosteus, Spinachia и Pungitius имеют cleithrum сходной формы: широкий край заднего конца рукоятки с острым дорсальным выступом на головке. Pungitius и Gasterosteus имеют гребень на заднем конце scapula, а под ним расположены несколько actinost. Coracoid расположен под scapula. В переднем отделе coracoid колюшковых нет отверстия, но следы его обнаружены у Apeltes, Culaea и Pungitius. У ближайших родственников колюшек — рыб сем. Aulorhynchidae — отверстие coracoid хорошо развито. Ectocoracoid (= infracleithrum) — наиболее вентрально расположенная кость плечевого скелета. У взрослых особей колюшек она частично сливается с вентральной частью coracoid. У Gasterosteus, Pungitius и Spinachia ectocoracoid вытянут вперед, вниз и по направлению к срединной линии тела рыбы.
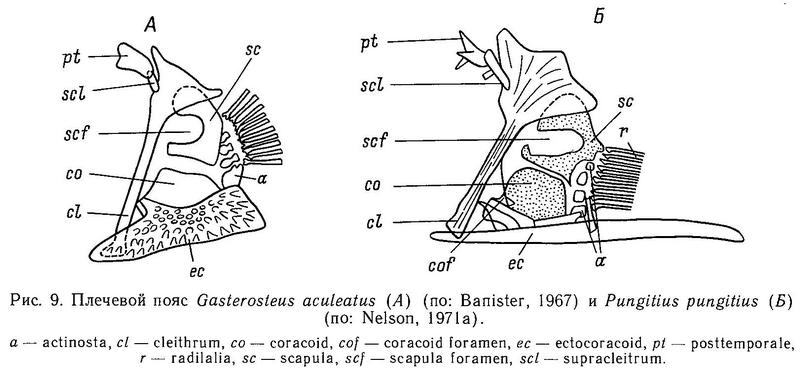
Ectocoracoid у Gasterosteus имеет треугольную форму, а у Pungitius и Spinachia — эта длинная и тонкая кость.
В целом наиболее сходные грудные скелеты (плечевые пояса) имеют Gasterosteus и Pungitius.
Структура яичников Pungitius pungitius сходна с таковой Gasterosteus aculeatus, и развитие ооцитов Pungitius pungitius идет по той же схеме, что и у Gasterosteus aculeatus. Существенное отличие от terosteus наблюдается у Pungitius при овуляции икры в полость яичника: овулирующая икра окружается слизью, секретируемой кубическими эпителиальными клетками, которые выстилают полость яичника. Эта студнеобразная слизь коагулируется в воде и способствует прикреплению икры к гнезду (Yamamoto, 1963). Эта особенность имеет адаптивное значение, так как гнездо у Pungitius строится над грунтом на растениях и есть опасность выпадения икры на грунт и ее последующей гибели. Для икры Gasterosteus, гнездящихся на грунте, такой опасности нет.
Самки Pungitius откладывают несколько кладок икры в нерестовый сезон. Наименьший интервал между последующими актами откладывания икры 6 ч, наибольший 48 ч (у Pungitius pungitius из Великих озер США — Griswold, Smith, 1973). В среднем интервалы между актами откладывания икры у Pungitius короче, чем у Gasterosteus aculeatus, но одноразовая плодовитость у Pungitius меньше: самки из оз. Верхнего (США) длиной 58—81 мм продуцировали 61 —112 икринок на 1 нерест (Griswold, Smith, 1973). Pungitius pungitius из устья р. Св. Лаврентия (Канада) имели одноразовую плодовитость 37—176 икринок (Fitzgerald, 1983). Диаметр икры равняется 1.4—1.8 мм (Nelson, 1968а). По нашим данным, одноразовая плодовитость самок Pungitius pungitius из р. Сходня (Московская обл.) в среднем составляет 140—160 икринок, плодовитость Pungitius platygaster из Сухого Лимана (г. Одесса) 80—90 икринок (Зюганов, 19846).
Самец Pungitius строит гнездо в отличие от Gasterosteus над грунтом среди растительности, чаще на расстоянии 10—15 см от грунта (хотя эта высота может колебаться от 2 до 20 см). Гнездо имеет сферическую форму, диаметр его 4—5 см. Как и у Gasterosteus aculeatus, гнездо имеет вход, выход и полный туннель, последний обычно имеет наклон, так что вход располагается ниже, чем выход (Leiner, 1931b; Morris, 1958) (рис. 17). Самец выбирает место для гнезда на мелководье, в стоячей, густо заросшей растительностью воде и начинает прикреплять строительный материал гнезда (обычно нити Spirogyra, Fontinalis, Nitella) на ветвях или на листьях водных укореняющихся растений. Поскольку гнезда строятся не на грунте, то и «репертуар» гнездостроительного поведения Pungitius отличается от Gasterosteus. Так, у Pungitius отсутствует элемент «копание грунта», который заменен элементом «расчистка места для гнезда среди растений». Кроме элемента «поверхностное склеивание» у Pungitius появляется дополнительный элемент «вставочное склеивание» (insertion glueing), при котором самец ловит ртом струю клея из клоаки (изгибаясь всем телом) и заталкивает эту «нить» клея внутрь гнезда. Вставочное склеивание появляется к концу гнездостроительной фазы и продолжается 1—2 дня после оплодотворения икры, его функция — цементирование внутренней поверхности гнезда, так как оно не скреплено грунтом снаружи, как у Gasterosteus. Кроме того, есть опасность выпадения икры из гнезда, и поэтому икра нуждается в дополнительном укреплении в гнезде. Все остальное элементы гнездостроительной фазы сходны с таковыми Gasterosteus (Morris, 1958).
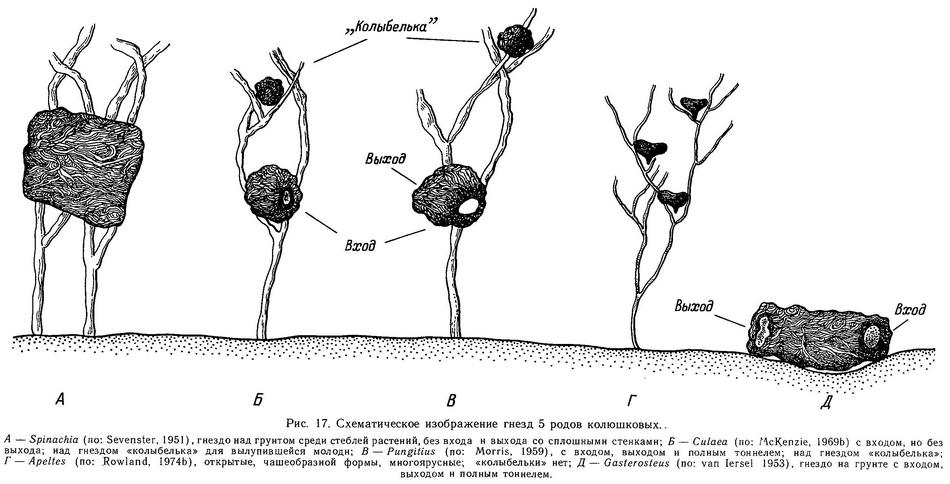
Описана популяция Pungitius pungitius в оз. Гурон (США), где нет укореняющихся растений в литоральной зоне (Gasterosteus aculeatus отсутствует) и самцы строят гнезда на грунте в расщелинах между камней. Кроме того, у гуронских самцов отсутствует элемент «поверхностное склеивание». Возможно, изменения в гнездостроительном поведении колюшек из оз. Гурон необратимы и генетически закреплены, так как в эксперименте при наличии выбора (когда самцам предлагались и укореняющиеся растения на песке, и каменный субстрат) они строили гнезда на грунте (McKenzie, Keenleyside, 1970). Самцы Pungitius pungitius из оз. Верхнее, пойманные в природе с илистого субстрата, где не было укореняющихся растений, а только слой водорослей (Nitella), также строили гнезда в аквариуме на грунте (Griswold, Smith, 1972, 1973).
Интересно, что интродукция 40 (20 самцов + 20 самок) основателей Pungitius pungitius из р. Сходня (Московская обл.), где самцы строят гнезда среди растений, в водоем, лишенный укореняющихся растений (карьер на побережье Белого моря), привела к тому, что самцы свободно перешли к постройке гнезд на грунте среди расщелин камней, как и в оз. Гурон. Обратное вселение самцов из карьера в водоем, имеющий растительность, привело к тому, что самцы снова стали строить гнезда среди растений. Это предполагает пластичность гнездостроительного поведения любой популяции Pungitius pungitius и приводит к заключению, что норма реакции по признаку «выбор субстрата для гнезда» весьма широка (Зюганов, 1986). Если нет привычного субстрата (растений), то в необычных условиях популяция перестраивается на «эксплуатацию» другого нерестового субстрата. Вуттон (Wootton, 1976) также полагает, что тип гнездостроительного поведения Pungitius — относительно пластичный признак, но приходит к выводу, что этот «тип» зависит от условий, в которых популяция эволюировала. Однако наши данные показывают, что это совсем не обязательно, и даже популяция, долгое время обитающая в «типичных» условиях, при попадании в необычные условия среды может изменить тип гнездостроительного поведения.
На Дальнем Востоке, на островах Сахалин и Хоккайдо (Япония) симпатрично обитают 3 вида девятииглых колюшек рода Pungitius (Pungitius pungitius, Pungitius sinensis, Pungitius tymensis). Часто их нерестилища перекрываются; судя по редкости нахождения гибридов между ними в природе и легкости их гибридизации искусственным путем (вплоть до появления плодовитых гибридов — Kobayashi, 1957), между ними имеется строгая поведенческая репродуктивная изоляция в природе.
Территориальные самцы не напрасно наиболее ожесточенно преследуют именно конспецифичных самцов, так как у колюшек можно наблюдать удивительное явление «похищения» икры из гнезда другими самцами. Эта икра или съедается, или «усыновляется» похитителем. Впервые «налеты на гнезда» были описаны для Pungitius (Morris, 1952) и для Gasterosteus aculeatus Драпкиным (1954). Действия «налетчика» на чужой территории отличаются своего рода «продуманностью». Нарушив границу чужой территории, «налетчик» опускается на дно, выпрямляет спинные колючки и принимает камуфлирующую окраску. Крадучись, он приближается к чужому гнезду по дну скользящими движениями и делая паузы между скольжениями. Последние несколько сантиметров, оставшихся до гнезда, он преодолевает стремительным броском. Если его обнаруживает владелец гнезда, то он обращается в бегство после выпада хозяина, но если он успевает достичь гнезда, то хозяину уже трудно выгнать вторженца, и тут разворачиваются самые интересные события. Если в это время владелец занят ухаживанием за самкой, то дальнейшее поведение «налетчика» зависит от того, на какой стадии находится брачная игра. Если владелец показывает самке вход в гнездо, «налетчик» прерывает его ухаживание и начинает «сверлить» гнездо, но в случае, если самка уже откладывает икру, «налетчик» пытается оплодотворить икру до владельца, что ему иногда удается. В том случае, если «налетчик» пробрался к чужому гнезду до брачного танца хозяина, он крадет гнездовой материал для своего гнезда (если он его еще не построил). Если в гнезде хозяина уже есть икра, он крадет ее и съедает (в том случае, когда сам еще не построил гнездо) или помещает в свое гнездо и далее ухаживает за икрой. Интересно, что если во время предыдущего рейда «налетчику» удалось оплодотворить икру в чужом гнезде, то следующим рейдом он пытается украсть эту икру (Morris, 1952; Драпкин, 1954; Van Den Assem, 1967; Wootton, 1971).
Ван ден Ассем (Van Den Assem, 1967) полагает, что функцией «налетов» является перераспределение икры в нерестовой колонии: похищает икру тот, кто не добился успеха в ухаживании за самкой; похищение икры приводит в итоге к синхронизации репродуктивного цикла самцов. Вуттон (Wootton, 1971) считает, что каждый самец на нерестилище будет иметь больший успех в выведении потомства, если все самцы на территории нерестилища будут включены в родительскую активность, чему способствует похищение икры. Драпкин (1954) полагает, что в конечном счете похищение и усыновление икры способствует сохранению численности вида, но Драпкин не объясняет, по каким причинам. Гомелюк (1978) полагает, что, поскольку во время нереста всегда имеется убыль самцов, охраняющих свои гнезда, усыновление гарантирует выведение икры чужим самцом, даже если «отец» погиб по каким-то причинам. Мак-Инерней (Mclnerney, 1969) отмечает, что «усыновление» свойственно всем колюшковым.
Кроме вентилирования самец во время родительской фазы удаляет мертвые икринки и возвращает обратно выпавшие из гнезда на грунт (Morris, 1958). Главное отличие родительского цикла Pungitius от Gasterosteus состоит в том, что Pungitius после вылупления молоди строит над гнездом «колыбельку» (специальную ловушку для молоди), куда помещает вылупившихся предличинок. «Колыбелька» строится из растительного материала, часто используется материал из гнезда. Через 3—4 дня после вылупления молодь всплывает на поверхность для заполнения воздухом плавательного пузыря и постепенно рассеивается среди растений, так что самцу становится все труднее хватать личинок ртом и выплевывать в «колыбельку». Через 1—2 дня самец «теряет» родительское поведение и готов к следующему нересту (Morris, 1958). Во время родительской фазы сексуальное поведение у Pungitius прекращается, а агрессивное усиливается, как и у Gasterosteus, причем фактором, вызывающим агрессию — «рилизинг-фактором» у Pungitius является черный цвет, так же, как у Gasterosteus — красный (Morris, 1958). «Налеты на гнезда» у Pungitius так же имеют место, как и у Gasterosteus, и впервые были описаны Моррисом (Morris, 1952) именно у Pungitius pungitius.
Описывая эволюцию и расселение рода Pungitius, Мюнцинг (Münzing, 1969) решающую роль отводит плейстоценовым оледенениям. Исходным предком всех форм он признает полностью вооруженный брюшными и спинными колючками, пластинами и килем морской эвригалинный тип. В плейстоцене в нескольких рефугиумах (свободных от ледников убежищах) ответвились новые виды и подвиды. Ведущую роль в формообразовании играла редукция костного вооружения в пресных водах. Предки современных Pungitius platygaster (гипотетические популяции Pungitius, покрытые щитками) проникли во время Рисского оледенения с севера в Каспий (возможно, через р. Урал?), а оттуда в Черное и Аральское моря. В Южной Европе был другой рефугиум, в котором возник подвид Pungitius pungitius laevis, полностью утерявший пластины и киль. У форм в восточоазиатском рефугиуме редукция пластин и киля была выражена слабее, судя по тому, что на Дальнем Востоке широко распространена Pungitius sinensis, покрытая пластинами и имеющая киль, больше всего похожая на гипотетического предка рода Pungitius (Munzing, 1969).
Из схемы Мюнцинга неясно, однако, из какого рефугиума распространилась Pungitius pungitius, имеющая самый обширный циркумполярный ареал. Эта форма не может быть предком всех прочих, поскольку у нее уже редуцированы пластины на теле. Мак-Фейл (McPhail, 1963) считает, что современная Pungitius pungitius на Североамериканском континенте могла распространиться из берингийского рефугиума (в районе Аляски). Возможно, она могла распространиться оттуда и на запад по Азии. В своих построениях Мюнцинг (Münzing, 1969) опять-таки не ссылался на палеонтологические данные. Хотя еще в 1934 г. в западносибирских пресноводных верхнетретичных (неогеновых) отложениях Штылько обнаружил отпечатки рыб, очень похожих на современных Pungitius pungitius и лишенных боковых пластин (он их назвал Gasterosteops) (Штылько , 1934). Плиоценовые находки Штылько в районе р. Ишим, притока Иртыша (бассейн р. Обь), противоречат схеме Мюнцинга, поскольку, как известно, плиоцен предшествует плейстоцену. Если уже в плиоцене в Сибири обитали предки Pungitius, лишенные боковых костных пластин, то маловероятно, что к плейстоцену они вторично стали «опластиненными» и под давлением наступающего ледника отступили в Каспий. Район, где Штылько обнаружил отпечатки, находится как раз на путях гипотетической миграции в Каспий предков Pungitius platygaster.
Вуттон (Wootton, 1976) сообщает, что в верхнетретичных отложениях Китая найдены ископаемые остатки Pungitius, ссылаясь на работу Лиу Хсиен-Тьинга и Ванг Ньен Чунга (Liu Hsien-T'ing, Wang Nien-Chung, 1974, — цит. по: Wootton, 1976), однако, к сожалению, этой работой я не располагаю.
4.3. ПАЛЕОНТОЛОГИЧЕСКИЕ ДАННЫЕ
В связи с небольшим количеством находок ископаемых остатков Gasterosteidae история семейства остается до сих пор малоизвестной. Удивительно, что до сих пор были описаны только ископаемые родов Gasterosteus и Pungitius, самых продвинутых и, очевидно, молодых родов. Белл (Bell, 1984), один из специалистов по палеонтологии колюшковых, утверждает, что «ископаемые остатки Gasterosteus и Pungitius полностью неинформативны в отношении филогении» (с. 436). Все ископаемые датируются миоценом, плиоценом и плейстоценом и найдены в морских и пресноводных отложениях Западной Сибири, Северного Китая, Аляски, Калифорнии, Невады (США) и не обнаружены в хорошо изученной пресноводной палеоихтиофауне Европы. В целом можно сказать, что миоценово-плиоценовые ископаемые колюшек приурочены к бассейну Тихого океана и в меньшей степени Северного Ледовитого океана.
В роде Pungitius к началу XX в. также было описано 19 видов (табл. 8), которые Бертэн (Bertin, 1925) свел в 1 — Pygosteus pungitius. Мюнцинг (Münzing, 1969), хотя формально признал существование 2 видов: Pungitius pungitius и Pungitius platygaster, до окончательного выяснения вопроса поддержал такое объединение, однако Берг (1949) с этим не согласился. Берг (1949, с. 965) выделяет 4 вида: Pungitius pungitius (с двумя подвидами Pungitius pungitius pungitius и Pungitius pungitius sinensis), Pungitius tymensis, Pungitius laevis, Pungitius platygaster (с двумя подвидами Pungitius platygaster platygaster и Pungitius platygaster aralensis). С сохранением видовой самостоятельности Pungitius pungitius и Pungitius platygaster согласились в дальнейшем европейские (Wootton, 1976; Gross, 1979) и американские (Bell, 1984) исследователи, которые, однако не признали видового статуса Pungitius laevis и Pungitius tymensis, но вслед за Бергом (1949) признают подвидовой статус Pungitius pungitius sinensis (Wootton, 1976; Bell, 1984). Однако японские исследователи (Kobayashi, 1957; Tanaka, 1982, и мн. др.) считают pungitius, sinensis и tymensis самостоятельными видами на Дальнем Востоке. Таким образом, таксономическая ситуация в роде Pungitius до сих пор остается запутанной. Подробнее проблема вида в роде Pungitius будет обсуждена в разделе 4.5.6.
Род Pungitius. Известны всего 3 находки Pungitius: из Западной Сибири (Штылько, 1934), северного Китая (Liu, Wang, 1974, — цит. по: Rawlinson, Bell, 1982) и Аляски (США) (Rawlinson, Bell, 1982).
Штылько (1934) по 7 отпечаткам описал новый род Gasterosteops из пресноводных плиоценовых отложений Западной Сибири (среднее течение Иртыша и Ишима). По всем меристическим признакам, размерам и пропорциям тела он не отличается от Pungitius pungitius, кроме 2 признаков: перед спинным плавником у Gasterosteops hexacanthus 5—6 колючек и в брюшном плавнике кроме колючки имеются 3 мягких луча. Тело голое, без щитков, и анальный плавник начинается под началом спинного так же, как у современной Pungitius. По числу спинных колючек Штылько (1934, с. 61) был склонен рассматривать род Gasterosteops как переходный между Pungitius и Culaea (= Eucalia), однако отмечал, что плохая сохранность отпечатков недостаточна для сравнения Gasterosteops с этими 2 родами. Нужно сказать, что число колючек у Gasterosteops вполне «вписывается» в размах колебаний числа колючек у современной Pungitius. Так, Уре (Ure, 1962, — цит. по: Nelson, 1971а) описал из Ирландии Pungitius pungitius с меньшим числом колючек, чем модальное 8—10, вплоть до того, что ему попадались колюшки с 1 колючкой. Берг (1940, с. 288) полагал, что Gasterosteops вряд ли отделим от Pungitius, так как «у Pungitius иногда бывает 6 спинных колючек и 2 брюшных неколючих луча». Плиоценовых Pungitius обнаружили в Северном Китае Лиу и Ванг (Liu, Wang, 1974, — цит. по: Rawlinson, Bell, 1982), однако этой работой я, к сожалению, не располагаю.
Ролинсон и Белл (Rawlinson, Bell, 1982) описали ископаемую Pungitius из плиоценовых прибрежно-морских отложений п-ова Кенаи (Аляска, США). Возраст ее определен авторами радиоуглеродным методом довольно точно — 7.2—6.9 млн. лет. Судя по отпечатку, рыба имела 9 спинных колючек, 15—20 боковых пластин, а в брюшном плавнике 1 колючку и 1 мягкий луч, ничем не отличаясь от современных Pungitius, по остальным признакам она была также схожа с Pungitius, кроме строения тазового пояса: восходящая дуга брюшной пластины пояса направлена не вверх (как у современных колюшек) , а вниз, что, впрочем, может быть связано, по мнению авторов, с условиями захоронения. Крупные размеры рыбы — стандартная длина тела 72.5 мм, а также наличие боковых пластин, длинные брюшные и спинные колючки позволяют авторам делать вывод, что палеоколюшки находились под прессом хищников. Запутанная внутривидовая таксономия, изменчивость Pungitius и неполное сохранение отпечатка не дают оснований для определения до вида этого ископаемого экземпляра (Rawlinson, Bell, 1982).
Плиоценовые находки Pungitius указывают на разделение родов уже в неогене, по крайней мере не позднее 7 млн лет тому назад. Все находки ископаемых Pungitius также не выходят за рамки современного ареала рода. Интересно, что находка плиоценового ископаемого экземпляра Pungitius на Аляске (Rawlinson, Bell, 1982) подтвердила более ранние представления Мюнцинга (Münzing, 1969) о предке Pungitius как о «морском типе», полностью «околюченном и опластиненном», однако плиоценовая находка Pungitius в Западной Сибири опровергла представления Мюнцинга о происхождении понтокаспийско-аральского вида Pungitius platygaster. Он полагал, что предками современных Pungitius platygaster были Pungitius, покрытые щитками, и они во время Рисского оледенения (плейстоцен) проникли с севера в Каспий. Находки Pungitius в Западной Сибири показали, что намного раньше плейстоцена, уже в плиоцене, в том районе, где должны были обитать гипотетические предки Pungitius, покрытые щитками, обитали лишенные щитков Pungitius. Это заставляет предполагать более раннее обособление Pungitius platygaster, вопреки мнению Мюнцинга.
Неогеновые находки Gasterosteus и Pungitius позволяют сделать заключение о направлении эволюции по крайней мере по трем признакам: числу лучей в брюшном плавнике, числу спинных колючек и боковых пластин. По всем трем признакам несомненно шла редукция, причем, если в неогене колюшки имели 3 луча в брюшном плавнике, то в наше время ни один вид колюшковых не обладает этой особенностью, а по остальным двум признакам редукция имела место в ряде неогеновых популяций, а в некоторых — нет; имеет она место и в ряде современных популяций.
Генетика морф в роде Pungitius. Генетическому анализу были подвергнуты 4 фенотипа: trachurus (=Pungitius sinensis (=1а)), trachurus без киля (Pungitius platygaster (=lb)), leiurus with a keel (=Pungitius pungitius (=3a)), hologymna with a keel (=Pungitius tymensis (=4a)). Все проведенные скрещивания, к сожалению, ограничены F1, поэтому полную модель наследования, адекватно отражающую генетический контроль признака «боковые пластинки», построить затруднительно. На основании расщеплений в F1 можно лишь судить (примерно) о количестве генов и доминантно-рецессивных отношениях фенотипов.
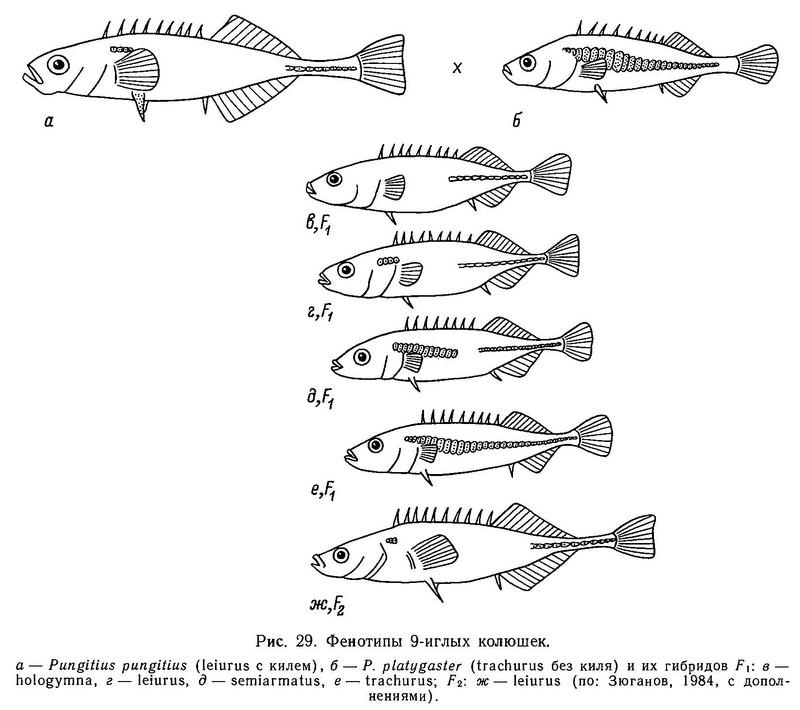
В скрещивании фенотипов «trachurus без киля (Pungitius platygaster) х «leiurus with a keel» (Pungitius pungitius) в F1 были получены следующие (рис. 29) расщепления (табл. 18) (Зюганов, 19846).

Ни один из типов расщеплений в этих скрещиваниях в роде Pungitius не соответствует расщеплениям при аналогичном скрещивании trachurus х leiurus в роде Gasterosteus и не описывается моделями наследования, разработанными для Gasterosteus aculeatus (табл. 20) (Зюганов, 1984б).

Так, в расщеплении типа 1 присутствует только фенотип hologymna (табл. 19) (нет пластин на теле) с пенетрантностью 100 %, что говорит о полном доминировании и даже, «сверхдоминировании» малого числа пластин над большим. У Gasterosteus в аналогичном скрещивании trachurus х leiurus (имеется в виду только признак «пластины на теле») фенотип hologymna никогда не выщеплялся, хотя скрещиваний подобного типа проведено несколько десятков разными авторами и в разных участках ареала, что исключает случайность. Ращепление типа 2 также показывает рецессивность фенотипа trachurus (=lb) у Pungitius. Расщепление типа 3 у Pungitius наиболее близко к расщеплению типа 6 у Gasterosteus (табл. 20), но все же у Pungitius в этом расщеплении присутствует фенотип hologymna с частотой 1/4, а у Gasterosteus этого нет. Можно полагать, что у Pungitius в отличие от Gasterosteus кроме основного гена «А» и модификатора «с» есть еще 1 или 2 гена, участвующих в детерминации признака «боковые пластины на теле».
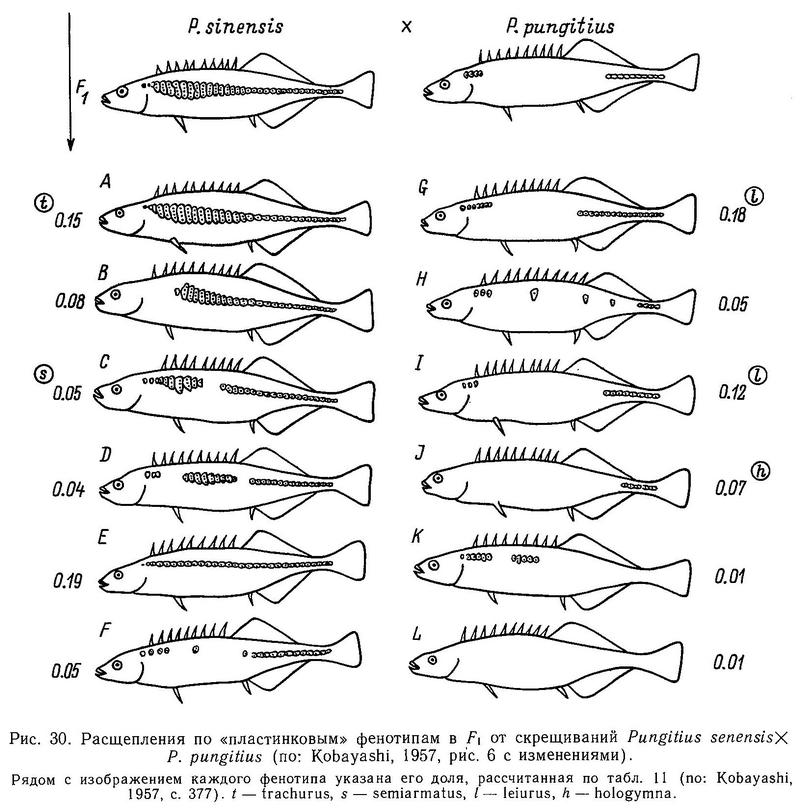
Кобаяши (Kobayashi, 1957) провел скрещивания Pungitius sinensis (=trachurus) х Pungitius pungitius (=leiurus) в Японии и получил в F1 большое число промежуточных вариантов, которые он разбил на 12 видов (рис. 30) с плавным переходом от trachurus к hologymna. Создается впечатление, судя по характеру расщеплений в F1, что у японских колюшек рода Pungitius характер детерминации этого признака не олигогенный, а полигенный, учитывая непрерывный характер изменчивости гибридов. Такие же результаты были получены им при скрещивании Pungitius sinensis (=trachurus) х Pungitius tymensis (=hologymna).
Судя по данным Кобаяши (Kobayashi, 1957) и нашим данным (Зюганов, 19846), киль у Pungitius — доминантный признак. Есть полное соответствие между расщеплениями по признаку «киль» у Gasterosteus и Pungitius; киль, в обоих родах — доминантный признак. Различия между 2 родами в наследовании киля выявляются лишь по экспрессивности. Так, у Gasterosteus у гибридов F1 от скрещивания «киль» х «отсутствие киля» киль в среднем на 30 % уменьшается по числу пластин, т. е. по протяженности, но гребневидность его остается отчетливо выраженной. В то же время у гибридов Pungitius pungitius х Pungitius platygaster в аналогичных скрещиваниях число пластин увеличивается в среднем на 50 %, а гребневидность почти исчезает, киль делается уплощенным (Зюганов, 19846).
Межрбдовые скрещивания (реципрокное скрещивание вызывало гибель потомства на ранних стадиях развития) самка Gasterosteus aculeatus (=trachurus) х самец Pungitius pungitius (=leiurus), проведенные Лейнером (Leiner, 1934), показали доминирование (неполное) фенотипа trachurus, не было гибридов с голыми боками, как Pungitius pungitius, но число пластин у них никогда не достигало 33, как у Gasterosteus aculeatus.
Спинные колючки. По числу спинных колючек есть высокодостоверные различия между Pungitius tymensis (М=10.8) и Pungitius pungitius (М=8.8). Скрещивание самка Pungitius tymensis х самец Pungitius pungitius дало в F1 среднее число колючек 10.5 (материнский эффект), а реципрокное скрещивание выявило среднее число спинных колючек у гибридов 9.8 (промежуточное наследование) (Kobayashi, 1957). Длина спинных колючек у Pungitius tymensis (3.7 % от длины тела) намного короче, чем у Pungitius pungitius (5.8) и Pungitius sinensis (6.1). Межвидовых гибридов первого поколения tymensis х sinensis и tymensis х pungitius очень легко отличить по этому признаку: казалось бы, все колючки у гибридов должны быть промежуточной длины, однако у гибридов короткие колючки чередуются с длинными (аддитивный эффект) (Kobayashi, 1957, с. 375) (рис. 32).

Похожими были результаты межродовых скрещиваний Лейнера (Leiner, 1934) Gasterosteus aculeatus х Pungitius pungitius, гибриды имели от 3 до 8 колючек, и короткие колючки (влияние генов Pungitius) чередовались с длинными колючками (влияние Gasterosteus).
Как уже отмечалось ранее (см. раздел 4.2), хромосомные наборы были изучены у всех (кроме Spinachia) родов колюшковых (Muramoto et al., 1969; Chen, Reisman, 1970). В данном разделе представляет интерес вопрос, различаются или нет кариологически разные формы и виды внутри полиморфных родов Gasterosteus и Pungitius. Мурамото и соавт. (Muramoto et al., 1969) показали, что на Дальнем Востоке Pungitius pungitius и Pungitius tymensis не отличаются ни по числу (2n=42), ни по структуре кариотипа, а Pungitius sinensis лишь незначительно отличается от двух первых по морфологии хромосом. Вид Pungitius platygaster имеет диплоидный набор хромосом: 2n=42 (Е. Ю. Крысанов, личн. сообщ.).
Факторы эволюции других видов колюшковых изучены намного слабее, чем у Gasterosteus aculeatus. Мюнцинг (Münzing, 1969) отводил большую роль плейстоценовым оледенениям, как фактору, приводящему к изоляции в разных рефугиумах плейстоценовых Pungitius, что привело к образованию аллопатричных форм Pungitius. В западно-европейском рефугиуме возникла беспластииковая форма laevis, а в понто-арало-каспийском «опластиненная» форма platygaster. В восточно-азиатском рефугиуме возникла опластиненная и с килем форма sinensis. Мак-Фейл (McPhail, 1963) также полагает, что морфологическая дифференциация в Сев. Америке на «берингийскую» и «миссисипскую» формы произошла из-за изоляции и дивергенции в берингийском и миссисипском плейстоценовых рефугиумах во время висконсинского оледенения. Однако Гросс (Gross, 1979), изучавший географическую изменчивость Pungitius pungitius, Pungitius platygaster, Pungitius pungitius laevis в Европе, обнаружил сходную клинальную изменчивость в широтном направлении всех трех форм по признакам «число лучей; в спинном и анальном плавниках, число спинных колючек», а по признакам «число жаберных тычинок, высота тела и длина брюшной колючки» он нашел межпопуляционную изменчивость, которую связывает с различиями в питании, гидрологических особенностях водоемов и давлением хищников. Таким образом, Гросс (Gross, 1979) полагает, что дифференциация по исследуемым признакам «произошла позднее, чем в плейстоцене, так как они чувствительны к среде», и эта изменчивость может быть скорее результатом влияния «длительных и стабильных условий внешней среды, чем результатом ледниковых событий». Будущие исследования покажут, альтернативны ли эти две гипотезы, или комбинативны» — заключает Гросс (Gross, 1979, с. 411).
Для рода Pungitius адаптивное значение полиморфизма по боковым пластинам менее понятно с точки зрения схемы, нарисованной для Gasterosteus. Pungitius platygaster и Pungitius sinensis имееют фенотип trachurus и обитают в основном в пресных водах. В морских же водах часто обитает Pungitius pungitius, имеющая фенотип leiurus. Непонятно также, почему у Pungitius в ряде случаев доминантным оказывается фенотип leiurus при скрещивании типа trachurus х leiurus (Kobayashi, 1957; Зюганов, 19846). Предположение, что фенотипы trachurus, используемые в этих скрещиваниях, были гетерозиготными, — меловероятно, так как колюшки этого фенотипа брались из мономорфных нерасщепляющихся популяций. Учитывая другой тип онтогенеза признака «боковые пластины» у Pungitius (Igarashi, 1962, 1964, 1968, 1969), можно полагать, что этот признак детерминируется иным морфогенетическим путем и в «игре» принимают участие другие гены. Возможно, здесь мы имеем дело с параллелизмом анатомическим, «... вытекающим из одинаковых возможностей развития, заложенных в органах, и наблюдающихся в систематических группах не ниже родовых» (Филипченко, 1925, с. 253). Поскольку роды Gasterosteus и Pungitius дивергировали уже в плиоцене, по крайней мере 7 млн. лет назад (Штылько, 1934; Rawlinson, Bell, 1982), неудивительно, что этот признак у них мог возникнуть на разной генетической основе.
Таксономические отношения pungitius — platygaster.
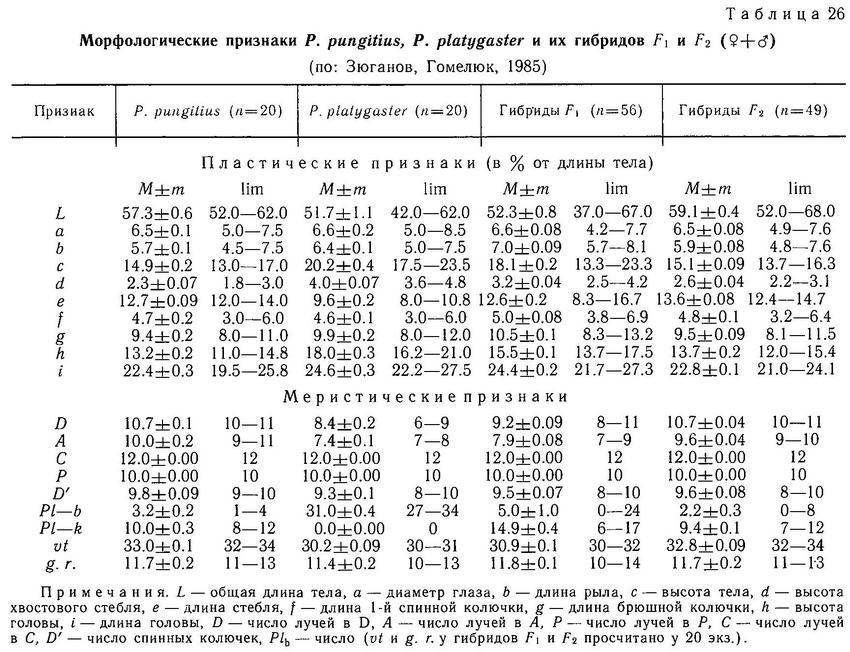
В Европе в настоящее время Pungitius pungitius обитает в бассейне Северного Ледовитого океана, Северного и Балтийского морей, а Pungitius platygaster — в бассейне Черного, Азовского и Каспийского морей. Их ареалы разделены незанятой областью. Pungitius pungitius имеет 0—5 (чаще 2—3) пластин на теле и хорошо развитый киль, у Pungitius platygaster киля нет, а на теле полный ряд пластин (30—34). Обе формы различаются и по ряду других признаков. Pungitius pungitius имеет больше позвонков и лучей в спинном и анальном плавниках, более низкое и длинное тело. Тело и хвостовой стебель Pungitius platygaster более короткие и высокие (табл. 26).
Хотя обе формы эврифаги, южная форма в большей мере бентофаг, склонный к скрытному, одиночному образу жизни в густой растительности. Северная форма — в большей мере планктофаг и хищник (поедает икру, личинок и мальков рыб). Она склонна к стайному пелагическому образу жизни и образует кроме жилой полупроходную форму. Очевидно, у Pungitius pungitius экологическая ниша шире (Зюганов, Гомелюк, 1985). Обе формы порционнонерестующие, но одноразовая индивидуальная плодовитость Pungitius pungitius больше. В биологии размножения и половом поведении между ними нет существенной разницы (Гомелюк, 1978) (рис. 35). Обе формы, например, и на Белом, и на Черном море начинают нерест при 17 °С. Количество хромосом у обеих форм 42 (Chen, Reisman, 1970; Е. Ю. Крысанов, личн. сообщ.).
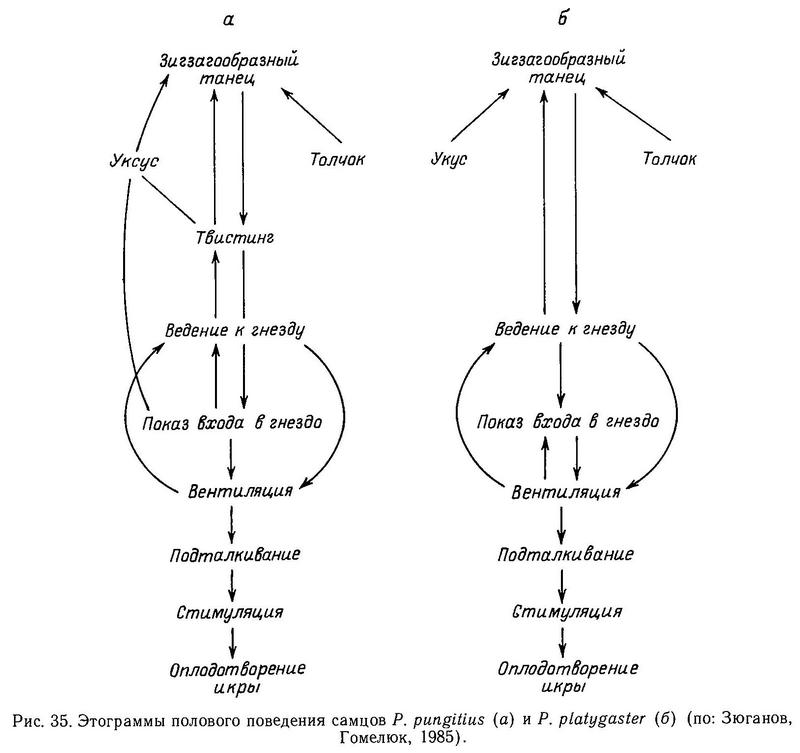
Большинство систематиков возводит эти формы в ранг видов (Берг, 1949; Gross, 1979), поскольку они обитают в разных природных зонах, а также имеют существенные морфологические отличия. Однако не всегда морфологические различия у аллопатричных форм коррелируют с наличием репродуктивной изоляции. Мюнцинг (Münzing, 1969) подчеркивал, что только эксперименты по скрещиванию прольют свет на истинные таксономические отношения между этими формами. Возможно, что дивергенция между ними не зашла далеко, и они всего лишь подвиды политипического вида. Мы предприняли попытку экспериментальных скрещиваний между 2 формами в аквариумах и природных водоемах на Белом море (Зюганов, Гомелюк, 1985).
Взрослые особи Pungitius pungitius были отловлены в р. Сходня (Московская обл.), куда в 70-х гг. они случайно были интродуцированы рыбоводами, а особи Pungitius platygaster — в Одесской обл. (Сухой Лиман). Внутривидовые и межвидовые скрещивания проводили в аквариумах, используя методику Фостера (Foster, 1977). Особенность этой методики состоит в том, что самка может свободно выбирать между конспецифичным самцом и самцом другого вида. Оказалось, что самки Pungitius pungitius и Pungitius platygaster почти равновероятно выбирают для нереста конспецифичных самцов и самцов «чужого» вида. Кроме того, когда самцу Pungitius pungitius или Pungitius platygaster, предлагали на выбор 2 самок — одну конспецифичную, а другую — «чужого» вида, во всех случаях и самец Pungitius pungitius, и самец Pungitius platygaster оплодотворял обеих (Зюганов, Гомелюк, 1985). Итак, аквариальные эксперименты показали отсутствие поведенческой репродуктивной изоляции между двумя таксономическими видами. Однако нужно было учесть, что при потенциальном контакте в природных условиях, несмотря на отсутствие поведенческих изолирующих механизмов, обмен генами между ними может быть затруднен из-за разных экологических предпочтений (Pungitius pungitius более пелагическая, а Pungitius platygaster более донная зарослевая форма). Кроме того, было неясно, плодовиты ли гибриды Pungitius pungitius х Pungitius platygaster или стерильны.
Мы провели групповые скрещивания pungitius х platygaster в природных изолированных водоемах (карьерах) на побережье Белого моря. Наблюдения за гибридными популяциями показали, что гибриды F1 и F2 плодовиты и жизнеспособны. Три созданные нами гибридные популяции способны к самовоспроизведению и существуют с 1981 г. в течение 4 лет, процветая и увеличиваясь в численности. Интересно, что если гибриды F1 фенотипически весьма разнообразны и мозаично наследовали морфологические особенности от обеих родительских форм (табл. 26), то гибриды F2 стали более однообразными и фенотипически сходными с Pungitius pungitius (Зюганов, Гомелюк, 1985). Следует сказать, что контрольная «чистая» форма Pungitius platygaster не выживает в северных условиях. Две попытки акклиматизировать здесь Pungitius platygaster оказались безуспешными. Несмотря на то что нерест Pungitius platygaster проходил успешно, мальки и взрослые, видимо, не выдерживают суровые северные зимы на широте 66°. Групповые скрещивания самцов гибридов с самками Pungitius pungitius также дают плодовитое потомство.
Итак, все эти опыты показали отсутствие пре- и посткопуляционных механизмов репродуктивной изоляции между Pungitius pungitius и Pungitius platygaster. Несмотря на то что обе формы имеют самостоятельные ареалы, развиваются (эволюционируют) независимо предположительно с плейстоцена в разных природных зонах и имеют различия в морфологии и экологии, между ними в случае контакта в природе (в умеренных температурных условиях) не будет непреодолимого изоляционного барьера. Контакт между ними ожидается в ближайшее время в Западной Сибири в р. Иртыш из-за нарушения ареала Pungitius platygaster (Зюганов, 19846), и можно предсказать интрогрессивную гибридизацию в случае этого контакта (Зюганов, Гомелюк, 1985) (рис. 36).
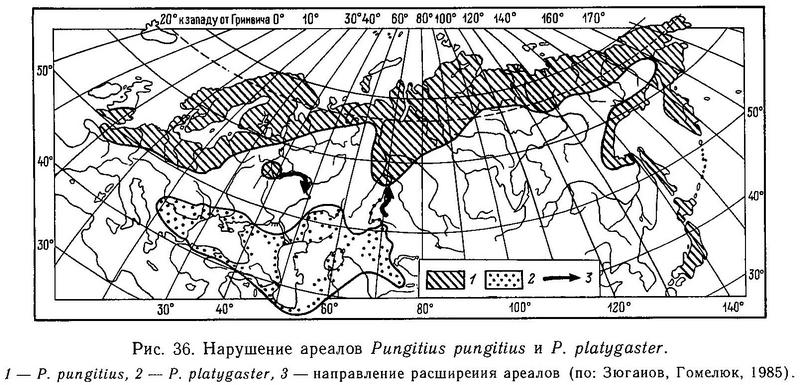
Таким образом, Pungitius platygaster и Pungitius pungitius не являются хорошими биологическими видами, но уже и не являются взаимозаменяемыми внутривидовыми формами из-за необратимой экологической дивергенции (разных температурных оптимумов). Две эти популяционные системы представляют промежуточные стадии дифференциации между разобщенными географическими расами и аллопатрическими видами. Дивергенция по морфологии и экологии у них не сопровождалась возникновением пре- и посткопуляционной изоляции. В эволюционном плане Pungitius pungitius и Pungitius platygaster следует рассматривать как полувиды (промежуточный статус между подвидом и видом), но в систематическом плане их следует оставить видами, поскольку еще мало доказательств того, что при широком контакте они сольются.
Таксономические отношения в группе pungitius — sinensis — tymensis на Дальнем Востоке.
В водоемах Дальнего Востока описаны три основные формы девятииглых колюшек рода Pungitius, таксономический статус которых вызывает споры. Форма pungitius имеет фенотипы leiurus + keel и hologymna + keel (от 0 до 5 пластин на теле) и киль. Форма tymensis имеет те же фенотипы, но отличается от pungitius отсутствием, мягких лучей в брюшном плавнике, киль у нее короче и менее развит, выходы каналов боковой линии по всему телу окаймлены костными ободками, брюшные и спинные колючки короткие, хвостовой стебель широкий и короткий. Форма sinensis имеет фенотип trachurus, у нее по сравнению с pungitius хвостовой стебель более длинный и узкий, больше позвонков и жаберных тычинок (Kobayashi, 1957) (рис. 37).
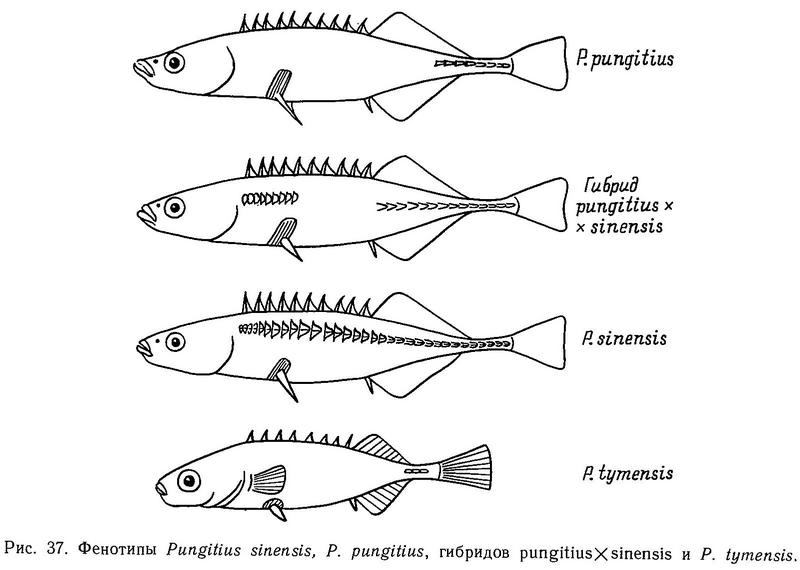
Форма pungitius обитает в прибрежных морских и пресных водах на материке — на Чукотке и Камчатке, в устье Амура, а также на островах — Шантарских, Курильских, Сахалине, Хоккайдо, Хонсю (Берг, 1949).
Советскими авторами sinensis рассматривается как подвид Pungitius pungitius (Берг, 1949; Никольский, 1956; Линдберг, Легеза, 1965, и др.) на том основании, что sinensis сменяет pungitius к югу от Камчатки в бассейнах Охотского, Японского и Желтого морей. Однако Берг (1949, с. 968) сам отмечал, что «в Амуре, в Охотском море, на Хоккайдо и на западном берегу Камчатки наряду с колюшками, покрытыми пластинками (т. е. sinensis — В. З.), встречаются и голые Pungitius pungitius». Кроме того, ареалы этих форм перекрываются на всех островах — Шантарских, Курильских, Сахалине, Хоккайдо и Хонсю. По этой причине pungitius и sinensis нельзя считать подвидами, так как ареалы подвидов, по определению, не должны значительно перекрываться. Подвид — совокупность фенотипически сходных популяций некоторого вида, населяющих часть ареала этого вида и таксономически отличных от других популяций того же вида» (Майр, 1971, с. 57).
Японские авторы (Kobayashi, 1957; Ishigaki, 1967; Igarashi, 1969; Tanaka, 1982, и др.) считают pungitius, sinensis, tymensis самостоятельными видами. Берг (19,49) считал tymensis видом, допуская возможность, что это одна из форм Pungitius pungitius. По данным японских авторов, на о. Хонсю (где перекрываются ареалы pungitius и sinensis) эти 2 формы фактически аллопатричны, т. е. обитают в разных реках: там, где живут pungitius, не встречается sinensis, и наоборот (Tanaka, 1982). Только в р. Хигара эти формы истинно симпатричны и «таксономически промежуточные фенотипы составляли 9.1 %, что свидетельствует о гибридизации между 2 видами и влечет за собой интрогрессию» (Tanaka, 1982).
Интересно, что в бассейне р. Магами (Хонсю) в окружении популяций фенотипа pungitius обитает популяция колюшек «Tendo», имеющих щитки по всему телу и киль (фенотип trachurus) (Igarashi, 1969). Эти колюшки выглядят как sinensis, однако от нее отличаются более мелкими щитками в грудной области. Называют таких рыб как «специальный тип Pungitius pungitius». Игараши (Igarashi, 1969) полагает, что типичный фенотип pungitius и фенотип trachura—pungitius из популяции Тендо являются результатом двух разных типов неотении фенотипа sinensis. Неотенизация (прерывание онтогенеза признака) последнего имеет место на более поздних стадиях жизненного цикла, чем первого. На этом основании Игараши (Igarashi, 1969) считает, что типичная pungitius и trachura-pungitius стали пресноводными жилыми в разное время и что каждый тип имеет свою собственную «эволюционную судьбу». Trachura—pungitius и sinensis различаются по структуре кариотипа, а также по э/ф-вариантам глюкозо- и галактозо-6-фосфат-дегидрогеназам (Muramoto et al., 1969).
В Японии также описана еще одна форма колюшки рода Pungitius, которая по характеру онтогенеза киля, а также по структуре щитков на киле не сходна ни с pungitius, ни с sinensis. Игараши (Igarashi, 1968) выделяет эту форму в самостоятельный вид Pungitius sp. Интересно, что по структуре кариотипа Pungitius sp. идентична Pungitius pungitius и Pungitius tymensis, но отличается от Pungitius sinensis. Однако по электрофоретическому спектру галактозо-6-фосфат-дегидрогеназы она идентична Pungitius pungitius, но отличается от Pungitius tymensis (Muramoto et al., 1969).
На о. Хоккайдо pungitius и sinensis также не встречаются в одних и тех же водоемах: в реках бассейна Охотского моря совместно обитают sinensis и tymensis, а в реках бассейна Тихого океана — pungitius и tymensis (Ishigaki, 1967). По данным Мурамото с соавт. (Muramoto et al., 1969), pungitius, sinensis и tymensis различаются по э/ф-вариантам двух вышеупомянутых ферментов, все они имеют 2n=42 хромосом, но по структуре кариотипа tymensis и pungitius идентичны, a sinensis достоверно отличается от них. Такова история вопроса. Видно, что таксономические отношения между 5 формами на Дальнем Востоке запутаны. Если большинство систематиков сходится во мнении, что Pungitius tymensis — самостоятельный вид, то в отношении других форм (и особенно форм pungitius и sinensis) много неясного. Понятно лишь одно, что концепция подвида в отношении форм pungitius и sinensis неприменима, поскольку ареалы их значительно перекрываются и как бы «вкраплены» друг в друга в шахматном порядке. Для разрешения этой проблемы нужно было найти такие водоемы, где они были бы истинно симпатричны. Тогда, сравнивая морфологические и иные признаки pungitius и sinensis, по наличию или отсутствию хиатуса можно было бы делать заключение о наличии или отсутствии репродуктивной изоляции в зоне контакта и решить проблему вида в группе pungitius—sinensis на Дальнем Востоке.
Такие водоемы были найдены нами в 1983 г. на Курильских островах и Сахалине. На о. Итуруп Курильской гряды в пресном оз. Рейдово (площадь 300х300 м) и реки, из него вытекающей (длиной 4 км) и впадающей в виде эстуария в Охотское море, были обнаружены 2 формы. В выборке из 1367 экз. оказалось 1282 экз. sinensis (93.8 %) и 85 экз. pungitius (6.2 %). По всей этой системе (устье ручья, впадающего в озеро — удаленная от моря и ближняя часть озера — верхняя, средняя, нижняя часть реки — устье реки) было сделано 7 выборок, чтобы выявить зависимость количественного соотношения форм по мере удаления от моря. Оказалось, что никакой «клинальности» нет, везде количественно доминирует sinensis. Однако непосредственно у зарослей водной растительности в любой части системы озеро—река pungitius встречалась с частотой 7.7—8.3 %, а в открытой части озера и реки; в толще воды над песчаным дном, — с частотой 0—0.75 %. Колюшек ловили сачком, предварительно подманивая их при помощи яркой белой бумажки на крючке, путем подергивания удочки. В этом водоеме sinensis является типичной пелагической стайной рыбой, тяготеющей к открытым пространствам. У нее типичная для пелагических рыб окраска: голубовато-зеленая однотонная спина и светлое брюшко. Форма pungitius, напротив, тяготеет к зарослям водной растительности и является придонной рыбой. Окраска у нее пятнисто-зеленая. Однако хищнический инстинкт у нее развит так же, как и у sinensis (она легко подманивается бумажкой из зарослей).
Судя по всему, кроме расхождения по биотопам у этих форм есть расхождение по срокам нереста. Так, в конце июля 1983 г. из 85 взрослых особей pungitius лишь самец имел брачную окраску, остальные самцы и все самки имели «пустые» гонады. Видимо, нерест у них уже закончился. В то же время большинство половозрелых самцов sinensis имели брачную окраску и находились у гнезд, самки были икряные. Видимо, у pungitius нерест проходит раньше, чем у sinensis. Различия в морфологических признаках между ними существенны (табл. 27). Очевидно, в местообитании «Рейдово» pungitius и sinensis являются репродуктивно изолированными, разошедшимися по разным экологическим нишам и срокам нереста формами. Там они ведут себя как хорошие виды. Только 1 экз. из 1367 исследованных имел фенотип, который можно трактовать как переходный между pungitius и sinensis.
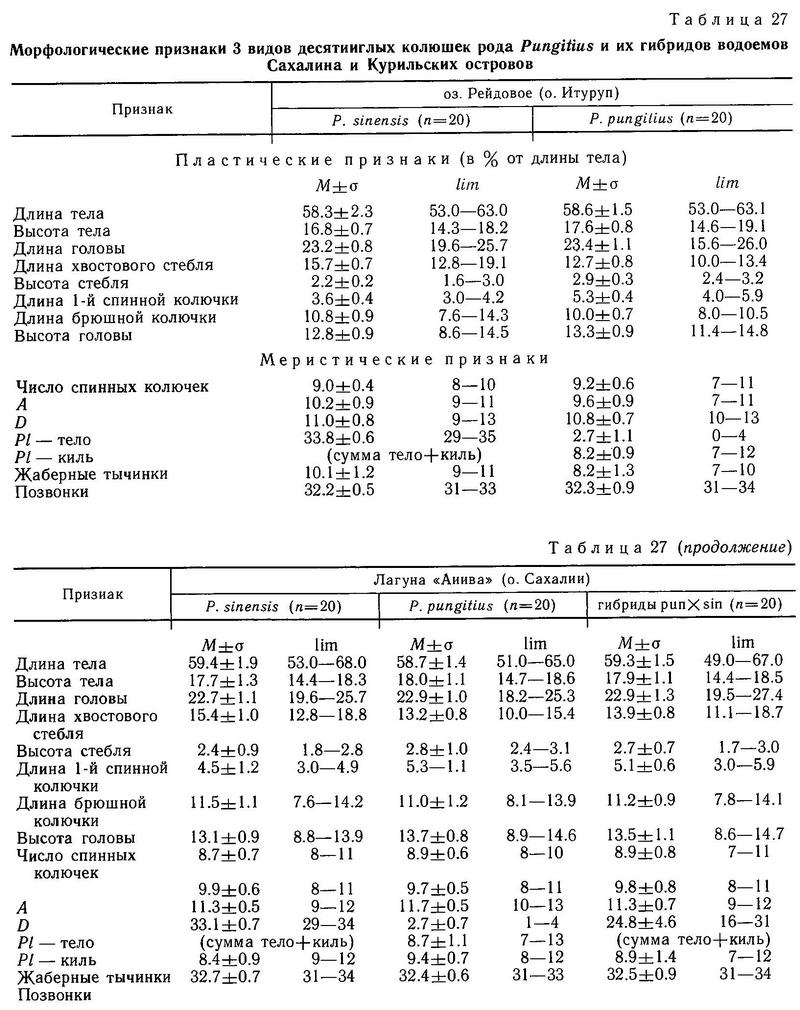
На о. Сахалин в 300 км от Курил нами были обнаружены водоемы, где все 3 формы (pungitius, sinensis, tymensis) встречаются вместе. Это озера Тунайча и Кормовое. Каждый из этих водоемов состоит из пресного озера и солоноватой лагуны, соединенных протокой. Соленость лагуны колеблется от слабосолоноватой (6 ‰) до 28 ‰, в зависимости от приливов. В пресной части обитают sinensis и tymensis, а в солоноватой части — pungitius. Sinensis и tymensis сосуществуют симпатрично (первый ведет стайный образ жизни в пелагиали, а второй обитает в зарослях водной растительности в литоральной зоне). Pungitius, не выходящий за пределы солоноватой зоны, является парапатричной формой по отношению к первым двум (рис. 38). Смещение морфологических признаков трех форм, обитающих в этих водоемах, является существенным. Недалеко от оз. Тунайча, на Южном Сахалине в таких же водоемах была обнаружена и иная ситуация. В оз. Чибисах и лагуне Анива отсутствует форма tymensis, и pungitius обнаруживает истинную симпатричность с sinensis. Pungitius проникает в пресную воду в этих водоемах, и обнаруживается значительная доля (24 и 31 % соответственно) промежуточных фенотипов по числу боковых пластин. По большинству остальных исследованных морфологических признаков средние достоверно не различаются и сближены (табл. 27).
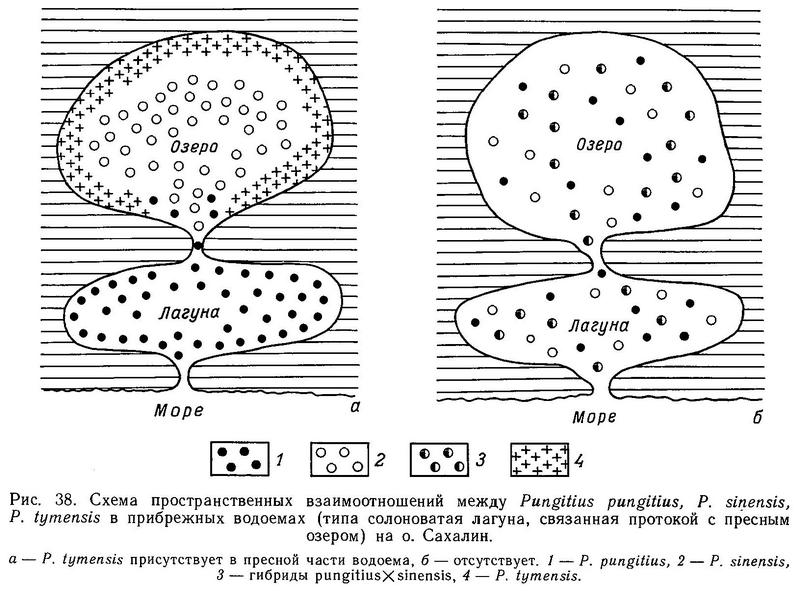
Очевидно, форма tymensis является хорошим видом по отношению к pungitius и sinensis, поскольку в зоне симпатрии с ними наблюдается разрыв по ряду морфологических признаков (длина стебля, высота стебля, длина брюшной и 1-й спинной колючки). Взаимоотношения между pungitius и sinensis сложнее. В тех водоемах, где присутствует пресноводная форма tymensis, pungitius не входит в пресную воду и является смежно-симпатрическим по отношению к sinensis и tymensis. Видимо, это объясняется большим сходством экологических ниш pungitius и tymensis (зарослевая литоральная зона). Там же, где нет tymensis, pungitius проникает в пресную воду, широко гибридизует с sinensis. Поэтому в водоемах типа Чибисах и Анива образуются смешанные популяции гибридов sinensis х pungitius.
Таким образом, на Сахалине вид Pungitius tymensis является как бы «изолятором», не допускающим пространственного и тем самым репродуктивного контакта между 2 формами в пресной воде. В то же время на о. Итуруп (где Pungitius tymensis отсутствует вообще) pungitius и sinensis истинно симпатричны и ведут себя как хорошие виды. Возникает вопрос — в чем причины различий ситуации на Сахалине и Итурупе? Видимо, ответ надо искать в различном возрасте этих островов (Курилы значительно моложе Сахалина) и, следовательно, в разном времени вторичного контакта 2 форм.
Из-за этого взаимоотношения sinensis и pungitius на 2 островах складывались по-разному. Судя по всему, pungitius и sinensis находятся на «полувидовом» уровне дифференциации и в одних частях ареала могут вести себя как хорошие, репродуктивно изолированные виды, а в других — широко гибридизовать или полностью сливаться. К этому добавим, что, по данным Кобаяши (Kobayashi, 1957), межвидовые гибриды sinensis х pungitius, sinensis х tymensis, tymensis х pungitius, полученные в эксперименте, росли и развивались, достигая годовалого возраста, и имели хорошо развитые гонады у обоих полов. Следовательно, в природных условиях механизмы репродуктивной изоляции у этих трех форм — биотопические и этологические.
Хотя популяционная структура в роде Pungitius иная, чем в роде Gasterosteus, у Pungitius имеются некие «блоки» популяций «pungitius», «laevis», «sinensis» и т. д., однородные внутри, но имеющие часто размытые границы в зоне контакта с соседними «блоками»; рассмотрение эволюционно-таксономической ситуации в этой группе по существу приводит нас к выводу, что, как и в роде Gasterosteus, популяции в таксоне Pungitius не «организованы» в виды в понимании биологической концепции вида.
Например, если брать в совокупности популяционные системы pungitius и platygaster в Европе, то здесь обнаруживается смесь признаков, сходных с расовыми и видовыми. Морфологически и экологически pungitius и platygaster достигли «видовой» стадии дивергенции. В то же время аквариальные эксперименты и экспериментальная гибридизация в условиях, максимально приближенных к природным (на Белом море), показали, что пре- и посткопуляционных механизмов изоляции между ними еще нет, гибридные популяции плодовиты и самовоспроизводимы. Майр (1971) в таких затруднительных для применения биологической концепции случаях предлагает сосредоточить внимание на главном свойстве вида — «защищенности генофонда». Попытаемся это сделать. Ясно, что в обсуждаемом нами случае генофонды двух совокупностей platygaster и pungitius не защищены ни разными биотопическими предпочтениями, ни этологической изоляцией, ни стерильностью или пониженной жизнеспособностью гибридов. Однако «чистая» популяция platygaster на севере не выживает из-за узкой приспособленности к «южным» условиям. Кроме того, из гибридных популяций на севере отбор, видимо, выбрасывает большинство генов platygaster, судя по почти полному морфологическому подобию гибридных популяций второго поколения и «чистых» популяций pungitius. Следовательно, в случае встречи и установления симпатрии platygaster и pungitius на севере генофонд pungitius будет защищен от «загрязнения» генами platygaster из-за низкой приспособленности последней к северным условиям. Встреча между ними на юге также может обернуться невозможностью внедрения генов pungitius в генофонд platygaster, поскольку икра pungitius не развивается при температуре 28 °С, обычной для нереста platygaster (Зюганов, Гомелюк, 1985). Зато нет никаких оснований ожидать взаимной защищенности генофондов в случае их встречи в природе в промежуточных условиях, скажем, при умеренных температурах воды. Такая встреча реально ожидается в Иртыше (Западная Сибирь) (Зюганов, 1984а). Следовательно, защищенность генофонда в разобранном примере зависит только от конкретных внешних природных условий, от места их встречи, что делает критерий «защищенности генофондов» весьма относительным, не рациональным и, разумеется, не являющимся внутренним свойством популяции.
Защищенность генофондов pungitius и sinensis на Дальнем Востоке также относительна и зависит от места их совместного обитания (Сахалин или Курилы), а также от наличия или отсутствия в водоеме «вида-изолятора» Pungitius tymensis, у которого экологическая ниша сходна с нишей pungitius. В некоторых местах sinensis и pungitius репродуктивно изолированы, а в других — широко гибридизируют и даже могут сливаться. В зависимости от желания исследователя их можно рассматривать как биологические виды, время от времени и в ряде мест гибридизирующие, а можно считать экологическими расами (sinensis — пресноводная, pungitius — солоноватоводная), разошедшимися в некоторых местах до уровня видов. Все зависит от того, каких ситуаций в природе больше, но чтобы это выяснить, придется сделать непосильную работу — обследовать десятки тысяч водоемов на достаточно обширной территории, где обе формы симпатричны, от о. Хонсю, до Камчатки. Но этого, видимо, и не требуется делать — важно знать, что могут быть реализованы все потенциальные исходы: от полной изоляции до полного слияния их генофондов.
Что касается таксономического статуса двух форм pungitius и sinensis на Дальнем Востоке, следует, видимо, пока считать их таксономическими видами, поскольку найдено больше таких ситуаций, когда они в зоне симпатрии репродуктивно изолированы (Зюганов, в печати; Tanaka, 1982; S. Tanaka, лич. сообщ.).
Таксономический статус беспластинковой (- голой) формы «laevis» в Западной Европе остается пока спорным. Берг (1949, с. 969) считал ее видом, правда никакого описания кроме характеристики «тело голое, киля нет» он не дает, так же как не дает аргументации за вид. Мюнцинг (Münzing, 1969) считает эту форму подвидом. Гросс (Gross, 1979) на основании того, что она «находится на юго-восточном конце клины по числу боковых пластин», и на основании того, что в Америке «миссисипи-форму Pungitius pungitius», также не имеющую пластин, Мак-Фейл (McPhail, 1963) не выделяет в подвид, предлагает «laevis» также не выделять в подвид. Однако, несмотря на то что я сам не исследовал эту форму, считаю, что она удовлетворяет требованиям, предъявляемым к подвидам, — имеет географическую самостоятельность (обитает в Западной Франции, Англии, Ирландии и Греции, существенно не перекрываясь пространственно с Pungitius pungitius) и надежно отличается от Pungitius pungitius отсутствием пластин и киля.
Стефанидис (Stephanidis, 1971) в бассейне р. Сперхиос (Греция) обнаружил колюшек рода Pungitius, лишенных полностью боковых пластин, киля на хвостовом стебле и брюшных колючек. Тазовый пояс у рыб был также редуцирован, причем на выборке из 40 экз. автор наблюдал изменчивость по выраженности редукции pelvis — от наличия брюшной пластины с зачатками колючек до остатков левой или правой косточек pelvis. Кроме того, спинных колючек было 1—6, т. е. меньше, чем это характерно для Pungitius. На основании того, что эта популяция Pungitius изолирована пространственно от остального ареала видов Pungitius (ближайшие популяции Pungitius platygaster — в Болгарии), а также на основании редукции тазового пояса и уменьшенного числа спинных колючек Стефанидис (Stephanidis, 1971) придает видовой статус этой популяции и называет ее Pungitius hellenicus n. sp. По остальным признакам (D I—VI 8—10, А I 8—10, Р 9—10, V 0—0, С 12) Pungitius hellenicus не отличается от Pungitius pungitius. Рисунок на с. 230, приведенный в указанной работе и описывающий Pungitius hellenicus, ничем не отличается от рис. 70 (с. 146), приведенного в работе Бертэна (Bertin, 1925) и описывающего Pungitius pungitius laevis (окраска, форма тела, пропорции тела, в частности высота тела, хвостового стебля, форма хвоста и т. п.). Таким образом, вероятнее всего, Стефанидис имел дело с реликтовой популяцией формы «laevis», и пока нет достаточных оснований выделять ее в самостоятельный вид. Этот «вид» не признан другими исследователями колюшковых (Wootton, 1976, 1984; Gross, 1979; Bell, 1984), поскольку у исследователей, имеющих дело с родами Gasterosteus и Pungitius, есть некое молчаливое соглашение не описывать каждую популяцию с морфологическими особенностями как вид; вследствие высокой изменчивости колюшковых пришлось бы бесконечно описывать многие сотни и тысячи видов. Так, беломорские популяции Pungitius pungitius без тазового пояса тоже бы пришлось описывать как вид, Pungitius pungitius laevis в Ирландии, Pungitius pungitius в Канаде, много популяций Gasterosteus — как виды и т. д. Итак, скорее всего, это Pungitius pungitius laevis.
Таким образом, после рассмотрения эволюционно-таксономической ситуации в роде Pungitius считаю оправданным выделение следующих таксономических видов: Pungitius pungitius, Pungitius platygaster, Pungitius tymensis, Pungitius sinensis, а форму «laevis» следует рассматривать как подвид Pungitius pungitius laevis.
Иллюстрированная энциклопедия рыб. Ст.Франк 1983 г.
К отряду относится семейство колюшковые (Gasterosteidae), включающее 5 родов. Три рода чисто морские, роды Gasterosteus и Pungitius - пресноводные, хотя первые два года их представители и живут в морской или солоноватой воде.
Словарь названий пресноводных рыб СССР. Г.У.Линдберг и А.С.Герд 1972 г.
20.2.0. Pungitius Coste, 1848 — Многоиглые колюшки
Жизнь животных. Том 4. Рыбы Под редакцией профессора Т.С.Расса 1971 г.
Род Девятииглые, или Малые, колюшки
(Pungitius) включает 4 вида,
распространенных в Европе, Азии и Северной
Америке.
Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Часть 2. (Acipenseriformes — Polynemiformes). Г.У.Линдберг, М.И.Легеза 1965 г.
2. Род PUNGITIUS COSTE, 1848
Pungitius Соstе, Mem. Sav. etrangers, Paris, 10, 1848 : 588 (тип: Gasterosteus pungitius Coste). — Берг, Рыбы пресных вод, 3, 1949 : 965 (описание, синонимия). — Matsubara, Fish Morphol. a. Hierar., 1955 : 408.
Перед спинным плавником (6) 7—12 (13) колючек, направленных в разные стороны (загзагообразно). Тазовые кости совершенно сращены между собой и образуют треугольную или ланцетовидную пластинку посреди брюха, позади и между брюшных плавников. Рыло умеренно удлиненное, не трубковидное. Брюшные плавники недалеко за грудными с I 0—1 (2) лучами: Кожа голая или покрыта тонкими костяными пластинками. Хвостовой стебелек с килем или без киля. Жаберные перепонки сращены между собою и образуют свободную складку поперек межжаберного промежутка. (Берг, 1949 : 965).
4 вида (Берг, 1949 : 965). Мацубара (Matsubara, 1955), следуя Бертену (Berin, 1925), принимает Pungitius tymensis за подвид Pungitius pungitius, что сделано и в настоящей работе. Следует заметить, что Л. С. Берг (1949 : 969) сам считал, что Pungitius tymensis, возможно, одна из форм Pungitius pungitius.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ВИДОВ РОДА PUNGITIUS
1 (4). Бока тела голые без костяных пластинок; только на хвостовом стебле имеется несколько костяных щитков, образующих киль.
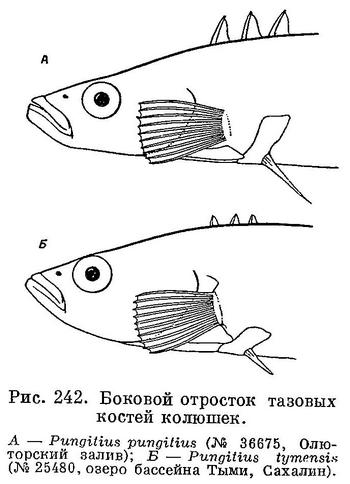
2 (3). Боковые (внешние, направленные вверх) отростки тазовых костей хорошо развиты, достигают горизонтали верхнего конца основания грудного плавника (рис. 242, А). Брюшные колючки длинные, 1.75—3 раза в длине головы. Спинные колючки высокие; высота средней колючки 2/3—3/4 диаметра глаза. Высота последней спинной колючки почти равна высоте предыдущих или лишь слегка превышает их. Киль на хвостовом стебле хорошо выражен. 1. Pungitius pungitius pungitius (Linne).
3 (2). Боковые (внешние, направленные вверх) отростки тазовых костей слабо развиты и едва достигают горизонтали нижнего конца основания грудного плавника (рис. 242, Б). Брюшные колючки короткие, 4—7.5 раз в длине головы. Спинные колючки очень низкие; высота средней колючки 2.5—5 раз в диаметре глаза. Высота последней спинной колючки в 2 раза больше высоты предыдущих. Киль на хвостовом стебле выражен очень слабо. la. Pungitius pungitius tymensis (A. Nikolsky).
4 (1). Бока тела на всем протяжении, или хотя бы частично, вооружены покрытыми кожей вертикальными костяными пластинками, образующими киль не только на хвостовом стебле, но и на боках тела. Брюшные колючки длинные, 1.75—3 раза в длине головы. Высота средней спинной колючки в 0.9—1.75 раза меньше диаметра глаза. Высота последней спинной колючки равна высоте предыдущих. 1б. Pungitius pungitius sinensis (Guichenot).
Рыбы северных морей СССР. А.П.Андрияшев 1954 г.
2. Род PUNGITIUS COSTE
Pungitius (Coste, 1848) Берг, Рыбы пресн. вод СССР, III, 1949 : 965 (тип: Gasterosteus pungitius L.).
Pygosteus Brevoort in: Gill, Proc. Ac. Nat. Sci. Phila., XIII (Suppl.), 1861 : 39 (тип: Gasterosteus occidentalis Cuv. et Val. = Gasterosteus pungitius L.).
Тело умеренно удлиненное, сжатое с боков, голое или с костяными пластинками. Хвостовой стебель короткий, сверху и снизу голый. Рыло короткое. Перед спинным плавником (6) 7—12 колючек. Брюшные колючки сидят почти сразу за основанием грудных плавников. Тазовые кости срощены в непарную брюшную пластинку. Жаберные перепонки соединены между собой и образуют широкую свободную складку поперек межжаберного промежутка.
4 вида в Европе, Азии и Сев. Америке. На севере один вид: Pungitius pungitius (Linne) — Девятииглая, или малая, колюшка.
Рыбы пресных вод СССР и сопредельных стран. Л.С.Берг 1948 г.
1. Род PUNGITIUS COSTE
Pungitius Coste, Mem. Sav. etrangers, Paris, X, 1848, p. 588 (тип: Gasterosteus pungitius). В этой работе прекрасно описывается устройство гнезда большими и малыми колюшками. Тип рода Pungitius не указан. Сообщается, что у Gasterosteus гнездо открытое, на дне, а у Pungitius — среди зарослей водяных растений. Бланшар (1866, стр. 210) говорит, что Кост имел дело с Gasterosteus leiurus и Pungitius laevis.
Pygosteus Brevoort in: Gill, Proc. Acad. Nat. Sc. Phila., 1861, suppl., p. 39 (тип: Pygosteus occidentalis = pungitius).
Gasterostea Sauvage, N. Arch. Mus. Hist. Nat. Paris, X, 1874, p. 29 (тип: Gasterostea pungitius).
Pungitius Fatio, Poissons de la Suisse, I, 1882, p. 97 (тип: Pungitius pungitius).
Gasterosteops Штылько, Тр. Геол.-разв. объедин., вып. 359, 1934, стр. 59, 87, табл. IX, фиг. 58—62 (верхнетретичные отложения Зап. Сибири; D V—VI, V I 3, позвонков 33; тип: Gasterosteops hexacanthus).
Перед спинным плавником (6) 7—12 колючек, направленных в разные стороны (зигзагообразно). Тазовые кости совершенно сращены между собою и образуют треугольную или ланцетовидную пластинку посреди брюха, позади и между брюшных плавников. Рыло умеренно удлиненное, не трубковидное. Брюшные плавники недалеко за грудными, с I 0—1 (2) лучами. Кожа голая или покрыта тонкими костяными пластинками. Хвостовой стебелек с килем или без киля. Жаберные перепонки сращены между собою и образуют свободную складку поперек межжаберного промежутка. Длина до 9 см.
4 вида в Европе, сев. и средн. Азии, Сев. Америке. Бертен (1925) соединяет все виды этого рода в один, Pungitius pungitius, с чем, однако, нельзя согласиться.
Виды этого рода, как и Gasterosteus, устраивают гнездо. Отложенную икру охраняет самец.
1 (6). Хвостовой стебель с боков с хорошо развитым килем.
2 (5). Передняя часть тела голая, без вертикальных костяных пластинок.
3 (4). Боковые (внешние, верхние) отростки тазовых костей хорошо развиты, брюшные колючки длинные, 1.75—3 раза в длине головы. Спинные колючки высокие. 1. Pungitius pungitius (L.)
4 (3). Боковые отростки тазовых костей почти отсутствуют, брюшные колючки короткие, 5—7.5 раз в длине головы. Спинные колючки
очень низкие. 2. Pungitius tymensis (Nikolsky)
5 (2). В передней части тела есть вертикальные костяные пластинки. la. Pungitius pungitius sinensis (Guichenot)
6 (1). Хвостовой стебелек гладкий, с боков без киля.
7 (10). Передняя часть тела более или менее покрыта вертикальными костяными пластинками. — Басс. Черного, Касп. и Аральск. морей.
8 (9). Брюшная колючка ясно зазубрена. — Черное и Каспийское моря. 3. Pungitius platygaster (Kessler)
9 (8). Брюшная колючка слабо зазубрена или не зазубрена. — Аральское море. 3а. Pungitius playgaster araiensis (Kessler)
10 (7). Тело совершенно голое. Pungitius laevis (Cuvier)

















